
MatriceLab Innove : bilan immunitaire de réceptivité utérine
Article rédigé par Dr Lédée Nathalie, MD PhD
Responsable centre de PMA des Bluets Paris- Directrice de MatriceLab innove- Pepinière Paris Santé Cochin- Paris
Historique et principe
L’embryon est toujours génétiquement différent de sa mère du fait de l’expression des gènes paternels. Il existe donc des mécanismes de tolérance immunitaire au moment de l’implantation embryonnaire pour non seulement empêcher son rejet mais au contraire stimuler sa nutrition et sa croissance. Cette réaction immunitaire a lieu spécifiquement dans l’endomètre au moment de la fenêtre implantatoire qui se situe 4 à 11 jours après l’ovulation. Durant cette période apparaît dans l’endomètre des cellules immunitaires spécifiques dont l’expression sera fondamentale pour permettre l’implantation embryonnaire et la construction du placenta (1, 2).
Après plus de 20 ans de recherche sur le dialogue immunitaire primordial entre l’embryon et la mère, l’équipe de MatriceLab a mis au point des biomarqueurs permettant d’explorer cette préparation maternelle à l’implantation. Chez la femme, l’endomètre se prépare à chaque cycle à une possible implantation, indépendamment ou non de la présence d’un embryon.
Le profil immunitaire utérin analyse cette réaction immunitaire dans l’endomètre en dehors de tout cycle de fécondation in vitro. Le but de l’analyse va être de vérifier que ces cellules sont bien présentes et que leur expression est adaptée.
L’implantation embryonnaire humaine se décompose en 3 phases: l’apposition, l’adhésion et l’invasion. L’embryon humain au stade de blastocyste (J5) va éclore et devoir se poser contre la paroi maternelle (apposition) puis adhérer. Ce phénomène est actif car spontanément l’endomètre est anti-adhésif pour protéger la mère d’une infection. L’endomètre ne devient donc adhésif que pendant cette courte période. Une fois l’adhésion faite, l’embryon humain va envahir la matrice maternelle. Aucune autre espèce ne présente une invasion aussi profonde. Elle dure 3 mois. C’est cette invasion massive qui permettra au placenta de nourrir le fœtus et de permettre son développement de son cerveau (3).
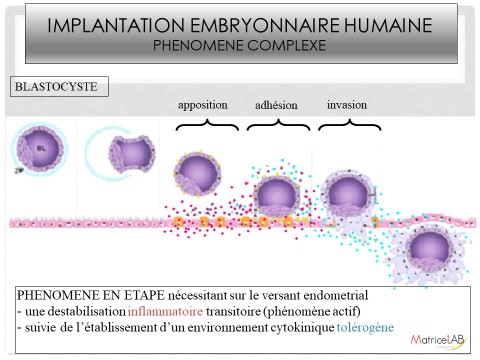
Dans ce cadre, nous avons mis en évidence qu’un certain nombre de cas d’échec d’implantation n’étaient pas dû à l’embryon mais à une préparation maternelle inadéquate.
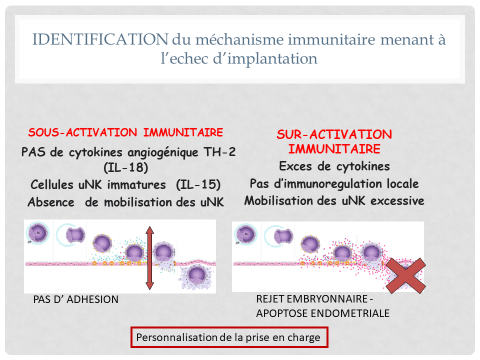
De manière très schématique, deux mécanismes peuvent aboutir à l’absence d’implantation ou à une fausse couche :
1- la réaction immunitaire ne se fait pas car les cellules immunitaires ne sont pas présentes ou sont immatures. L’endomètre reste antiadhésif et l’embryon transféré ne parvient pas à adhérer à l’endomètre.
Dans le cas de fausse couche, l’embryon a néanmoins réussi à se poser mais il n’est pas suffisamment nourri et la grossesse s’arrête
2- Les cellules immunitaires sont bien présentes mais elles sont hyper-activées et deviennent tueuses. Elles reconnaissent l’embryon comme étranger. Il est alors rejeté. Dans le cas des fausses couches, c’est le même mécanisme, le placenta est détruit et la grossesse s’arrête.
Solutions proposées
Sur la base d’un diagnostic précis, nous avons proposé de personnaliser la prise en charge pour rééquilibrer l’environnement utérin dans lequel sera transféré l’embryon (4).
Le médecin reçoit 3 semaines après le bilan immunitaire utérin des suggestions de personnalisation pour le prochain traitement.
Ces suggestions vont détailler s’il faut :
- Préparer l’endomètre le cycle précédant en faisant ou non un scratching pour augmenter l’adhésion embryonnaire le cycle suivant.
- Si il faut éviter ou non un niveau élevé d’oestrogène pour la préparation pour le transfert.
- S’il faut rajouter des médicaments en cours de stimulation ou après la ponction (ovitrelle en phase luteale, corticoïdes, anticoagulants, intralipides).
- Le type de support lutéal nécessaire après le transfert (dose de progestérone usuelle ou augmentée, adjonction ou non d’oestrogène).
- S’il faut ou non avoir des rapports sexuels après le transfert.
Seul le médecin est apte à valider ces suggestions.
Du Concept à la preuve du bénéfice
Toute innovation nécessite d’être prouvée.
Cette démarche n’ayant jamais été proposé dans le monde, nous avons commencé par étudier chez 394 femmes en échecs d’implantation (malgré le transfert de plus de 6 embryons de bonne qualité) si la personnalisation du soin en fonction du profil immunitaire utérin permettait d’augmenter les taux de naissance au premier transfert d’embryon frais ou congelés suivant le bilan.
Etant donné le passé d’échecs d’implantation, sans mesure particulière, le taux attendu de naissance était de 20% au premier transfert.
- 82 % des femmes présentaient une dérégulation
- 56% avaient une hyper-activation et
- 25 % une sous-activation immunitaire.
Le taux de naissance au premier transfert était de 36.8% dans le groupe suractivé et de 46.5% dans le groupe sous-activé, soit très significativement plus haut que le taux attendu (5).
Les femmes n’ayant pas de dérégulation avait par contre le taux de naissance attendu de 19%.
Nous avons ensuite fait une étude avec un groupe contrôle car de fait la qualité embryonnaire est tout à fait fondamentale. Il convenait donc de comparer deux groupes ayant des données embryologiques comparables.
Nous avons donc comparé deux groupes ou chaque femme ayant eu un bilan était appareillé à une autre femmes ayant le même âge, le même nombre d’ovocytes obtenu à la ponction, la même technique de mise (FIV, ICSI, transfert d’embryon congelé), le même nombre d’embryon transféré, le même stade d’embryon (J3 et J5) mais pas de bilan immunologique.
Le taux de naissance dans le groupe avec bilan était significativement plus haut que dans le groupe non analysé (27.5% versus 16%), et le taux de fausse couche significativement réduit (17% versus 41%/ grossesse débutante) (6).
Depuis 2016, nous menons dans le cadre d’un programme hospitalier de recherche clinique une étude randomisée prospective contrôlée.
500 femmes en début de parcours de Fécondation in vitro bénéficie d’un bilan immunologique utérin. En cas de dérégulation, une randomisation décide au hasard de prendre en compte ou pas les conseils de personnalisation au premier transfert d’embryon suivant le bilan.
L’hypothèse de base est que le bilan immunologique d’implantation augmente de 50% les naissances vivante. Cette étude nous permettra d’une part de prouver le bénéfice et de pouvoir savoir quand il est nécessaire de faire ce bilan pour optimiser les naissances. Les résultats de cette étude sont attendus en 2020.
Sur la base de ces résultats, nous proposons maintenant ce bilan pour les patientes en échecs d’implantation (avec leur propre ovocytes et en don d’ovocytes) et dans le cadre des fausses couches à répétition inexpliquées. L’ensemble des détails relatif au bilan sont disponible sur le site matriceLab.
Le coût de MatriceLab Innove
Le coût est de 500€ non remboursé par la Sécurité Sociale. Toutes les démarches visant à prouver le bénéfice socio-économique sont en cours.
Site internet
Bibliographie
- Ledee-Bataille N. [Materno-foetal dialogue and human embryo implantation: some evolving concepts]. J Gynecol Obstet Biol Reprod (Paris). 2004;33(7):564-76.
- Chaouat G, Petitbarat M, Dubanchet S, Rahmati M, Ledee N. Tolerance to the foetal allograft? Am J Reprod Immunol. 2010;63(6):624-36.
- Chaouat G, Mas AE, Petitbarat M, Dubanchet S, Ledee N. [Physiology of implantation]. Gynecol Obstet Fertil. 2007;35(9):861-6.
- Ledee N, Petitbarat M, Rahmati M, Dubanchet S, Chaouat G, Sandra O, et al. New pre-conception immune biomarkers for clinical practice: interleukin-18, interleukin-15 and TWEAK on the endometrial side, G-CSF on the follicular side. J Reprod Immunol. 2011;88(2):118-23.
- Ledee N, Petitbarat M, Chevrier L, Vitoux D, Vezmar K, Rahmati M, et al. The Uterine Immune Profile May Help Women With Repeated Unexplained Embryo Implantation Failure After In Vitro Fertilization. Am J Reprod Immunol. 2016;75(3):388-401.
- Ledee N, Prat-Ellenberg L, Chevrier L, Balet R, Simon C, Lenoble C, et al. Uterine immune profiling for increasing live birth rate: A one-to-one matched cohort study. J Reprod Immunol. 2017;119:23-30.









Mon mari et moi-même vous remercions pour vos différents contenus. Ils sont très très souvent clairs et instructifs.
Cela nous permet de prendre connaissances des différentes avancées médicales en lien avec la PMA. Ou tout simplement de mieux comprendre notre propre chemin.
Merci.
Merci pour votre site – vos articles m’apportent des informations qui me font réellement avancer.